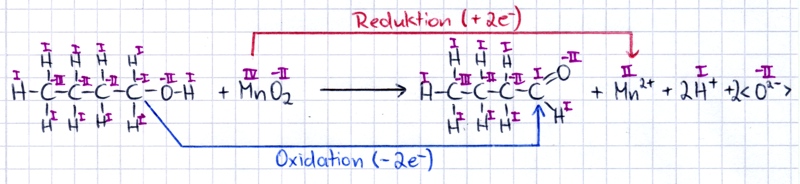
In dieser Übungsaufgabe kommt ein neues Oxidationsmittel zum Einsatz: Braunstein. Beim Aufstellen der Reaktionsgleichung - hier ändert sich zunächst ja nur die Reduktionsgleichung - kann man jedoch ganz systematisch wie zuvor vorgehen. 1-Butanol wird zu Butanal oxidiert - diese Reaktion "liefert" wieder einmal 2 Elektronen und 2 Protonen.
| Auch dieses Oxidationsmittel
benötigt zur Reduktion je Formeleinheit MnO2
zwei Elektronen. Das
Manganatom im Braunstein besitzt die Oxidationszahl IV und wird durch
Aufnahme von zwei Elektronen zum Manganion Mn2+
reduziert. Dieses Ion
kann frei in der wässrigen Lösung existieren, man schreibt dann häufig
auch Mn2+(aq). Bei der Reduktion von einem Mol Braunstein entstehen auch zwei Mol Oxidionen (<O2->). Die Oxidation des 1-Butanols liefert jedoch je Mol nur zwei Protonen (H+). Bislang konnten die Oxidionen mit den entstehenden Protonen (H+) zu Wasser reagieren - hier geht diese Rechnung allerdings nicht mehr auf! Wir wissen aber, dass die Oxidionen viel zu reaktiv sind, um frei im Wasser existieren zu können. Die Lösung des Problems steckt in der Aufgabe: Die Reaktion soll in einer sauren Lösung stattfinden! Saure Lösungen enthalten Protonen (H+-Ionen - diese machen den sauren Charakter einer Lösung aus). Wir können unsere Gesamtgleichung mit Protonen ausgleichen und erhalten so folgende Gleichung: |

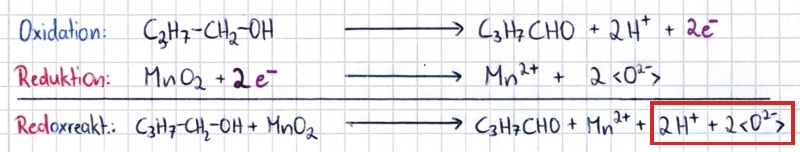
| Schließlich noch die Reaktionsgleichung mit Lewisformeln und Oxidationszahlen: |